INFORME TÉCNICO
Prueba de la tuberculina: eje central para la detección de tuberculosis en bovinos
Hasta la actualidad no se ha logrado reemplazar su eficacia y practicidad por nuevos desarrollos tecnológicos que buscan también mitigar el impacto de la enfermedad.
La tuberculosis (TB) refiere a una infección causada por un grupo de micobacterias estrechamente relacionadas entre sí, denominado Complejo Mycobacterium tuberculosis. En el ganado bovino, la principal especie causante de TB es el Mycobacterium bovis (M. bovis), una micobacteria que también puede infectar al hombre y a otras especies de animales domésticos y silvestres.
Los signos clínicos de TB en el bovino pueden ser muy variables, dependiendo del / los órgano(s) afectado(s). Asimismo, un bovino con TB puede mantenerse subclínico por largos periodos de tiempo y aún así, transmitir la infección a otros individuos susceptibles.
En este contexto, resulta crucial poder discernir a través de pruebas diagnósticos a aquellos animales infectados por M. bovis.
La detección y segregación de los mismos, fue y es clave en los programas de control y erradicación. Entre las pruebas diagnósticas que evalúan inmunidad celular, la referencia a nivel mundial es la prueba de la tuberculina (PT). El fin de presenté artículo es repasar algunos conceptos históricos, de validez y uso de la PT basados en investigaciones y la normativa nacional.
Breve historia
El 24 de marzo de 1882 el científico alemán Robert Koch presentaba a la Sociedad de Fisiología de Berlín, su trabajo titulado “La etiología de la Tuberculosis”.
Por primera vez, se confirmaba que una bacteria era la causa de la TB lo cual revolucionó la percepción global sobre esta enfermedad. En 1890, Koch anuncia sus investigaciones sobre la tuberculina (un extracto de los bacilos de la TB) intentando encontrar un tratamiento para la enfermedad. Y aunque la tuberculina resulto ser ineficaz para tratar la TB, pronto se determinó que podía resultar útil para discernir entre individuos infectados e individuos no infectados. En 1891, McFadyean realizó estudios en bovinos demostrando que la inoculación subcutánea de tuberculina generaba una reacción febril en aquellos animales con TB.
En 1893, Bang utiliza la tuberculina como herramienta diagnóstica del programa oficial de control de TB bovina en Dinamarca. Entre 1907 y 1908, Von Pirquet y Mantoux demuestran que inocular la tuberculina en forma intradérmica produce una reacción evidenciable en individuos con TB. En 1930, Seibert desarrolla un proceso de purificación de las proteínas activas de la tuberculina con propiedades antigénicas que se conocería como derivado proteico purificado (PPD de sus siglas en inglés, purified protein derivative).
El PPD resultante, podía ser estandarizado con facilidad y precisión.
En 1952, la Organización Mundial de la Salud (OMS) adopta al PPD como la tuberculina internacional estándar. En 1983 se establece en Argentina, que todas las partidas de PPD producidas serán controladas por el SENASA y elaboradas de acuerdo con los estándares de la OMS.
Diagnóstico
La PT (también llamada prueba de hipersensibilidad retardada o intradermoreacción) es el método de referencia de la Organización Internacional de Sanidad Animal (OIE) para la detección de TB bovina.
Básicamente, la prueba consiste en medir el espesor de la piel en el sitio a inocular, aplicar la tuberculina en forma intradérmica y luego volver a medir la piel a las 72 hs post-inoculación. La implementación de esta técnica permite poner de manifiesto una infección retrospectiva de TB. Al aplicar la PT en un bovino con TB se desarrolla, en el sitio de inoculación, una infiltración densa de la dermis por células mononucleares (reacción de hipersensibilidad).
Varios países que implementaron programas de erradicación de TB bovina basando su estrategia en la aplicación sistemática de la PT y la eliminación de los positivos han logrado, en conjunto con otras medidas, erradicar la infección de sus rodeos. Ejemplo de ello fueron los progresos reportados por Australia, Canadá, países miembros de la Unión Europea y gran parte de Estados Unidos.
n otros países, esta metodología logró reducir la incidencia de TB bovina, pero no logró su completa erradicación. Esto último, podría atribuirse a diversos factores como, por ejemplo, la existencia en algunos países de reservorios de M. bovis en animales silvestres. Por otro lado, la falta de incentivos o compensaciones económicas podría limitar el progreso del saneamiento de TB en otros países. En Argentina, la PT es el eje central del diagnóstico de TB en el que se basa el Programa Nacional de Control y Erradicación (Resolución SENASA 128/2012).
Validez del diagnóstico
El éxito de diversos programas de erradicación basados en la PT demuestra la confiabilidad de la reacción como indicador de infección-enfermedad.
Sin embargo, y como toda prueba diagnóstica, la PT no es infalible y puede tener una falta de precisión al clasificar a los animales. Esto puede ser cuantificado a través de sus valores de sensibilidad (proporción de infectados-enfermos clasificados como positivos) y especificidad (proporción de no infectados-enfermos clasificados como negativos).
A partir de estos dos conceptos, podemos hablar entonces de una proporción de falsos negativos y falsos positivos.
Los motivos por los cuales un bovino infectado-enfermo por TB puede resultar negativo (falso negativo) a la PT pueden ser varios.
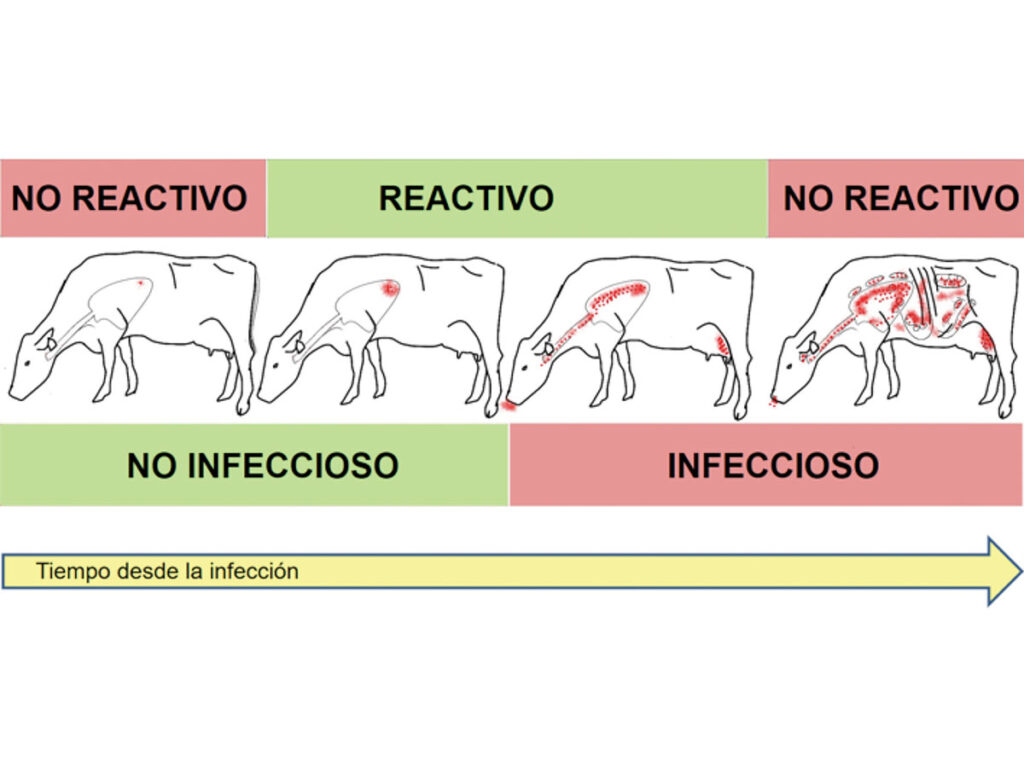
Un ejemplo de ello es la aplicación de la PT durante el estado pre-alérgico, que es el tiempo que transcurre entre la infección y el desarrollo de una respuesta inmune detectable (Figura N° 1).
Este tiempo puede ser de entre 3 y 6 semanas, aunque algunos estudios señalan periodos más extensos. Otra potencial causa de falso-negativo es la aplicación de la PT en animales desensibilizados, cuando no se respeta el intervalo mínimo de espera entre pruebas (60 días).
Por otro lado, pueden influir en la respuesta a la PT todos aquellos factores estresantes para el bovino que alteran el sistema inmune. Dichos factores pueden ser fisiológicos (ej. postparto temprano) o ambientales (ej: malnutrición, transporte, etc.). Asimismo, la aplicación de glucocorticoides sintéticos como la dexametasona puede reducir drásticamente el tamaño de reacción o impedir la respuesta a la PT.
Bovinos con TB generalizada y/o con un estado avanzado del cuadro patológico pueden no responder en forma positiva a la PT.
Otras causas de anergia pueden ser las infecciones concomitantes que afectan la respuesta del sistema inmunológico, por ejemplo: la diarrea viral bovina, las parasitosis y/o la paratuberculosis.
La administración errónea del PPD, en forma subcutánea, también puede resultar en un falso-negativo. Es por ello que, la formación de una pápula visible es crucial para poder identificar la inoculación intradérmica del PPD.
Para un correcto diagnóstico, el PPD debe conservarse entre 2 y 8 °C y evitar exponerlo a la luz solar y el calor.
Los frascos de tuberculina, una vez abiertos, solo pueden reutilizarse en un tiempo máximo de 24 horas.
Los motivos por los cuales un bovino no infectado-enfermo de TB puede resultar positivo (falso positivo) a la PT son limitados. Esto podría ocurrir debido a que otras micobacterias no tuberculosas presentan proteínas análogas a las del M. bovis, pudiendo ocasionar una reactividad cruzada. Por ejemplo, la infección por M. avium subsp. paratuberculosis (agente causal de la paratuberculosis) podría dar reacción cruzada a la PT.
Finalmente, será el veterinario acreditado para el saneamiento de TB el que, en conocimiento de las limitaciones de la PT, interpretará los resultados basados en el contexto epidemiológico del rodeo.
De esa manera, establecerá el plan de saneamiento más adecuado considerando el control de los factores de riesgo para la transmisión de la infección.
Sitios de inoculación
» Prueba ano caudal
Es la PT de rutina en Argentina y consiste en la inoculación de 0,1 mL de PPD bovina en el pliegue ano caudal interno, a unos 6 cm por debajo de la base de la cola. Si la piel se observa contaminada, es importante limpiar el sitio de inoculación con un algodón seco.
Si existen antecedentes de TB se deberá implementar una interpretación “severa” (toda reacción ≥ 3 mm es positiva). Mientras que, en situaciones desconocidas o sin antecedentes de TB, se realiza una interpretación “estándar” (reacción ≥ 3 mm es sospechosa, reacción ≥ 5 mm es positiva).
Es importante aclarar que el tamaño de la reacción a la PT no es indicativo el número de bacilos infectantes ni de la severidad de las lesiones, aunque se han asociado reacciones fuertes a infecciones recientes.
La sensibilidad y especificidad reportada para esta prueba es de entre 75-82% y 96-99%, respectivamente.
En otros países que aplican la PT en el pliegue ano caudal, utilizan el pliegue externo. Investigaciones del autor, demostraron que las reacciones en los pliegues internos y externos están significativamente correlacionadas, aunque se registran engrosamientos de mayor tamaño en el pliegue externo.
Este último, al ser más grueso, podría facilitar la aplicación intradérmica y la interpretación subjetiva por palpación, como utilizan en otros programas de control.
» Prueba cervical simple
Consiste en la inoculación de 0,1 mL de PPD bovina en un pliegue cervical del tercio medio del cuello. Su aplicación requiere de la inmovilización del animal para una correcta maniobra de inoculación lo que resulta en un proceso más laborioso. Debe rasurarse el sitio de inoculación cuidando de no irritar la zona. Todo engrosamiento del pliegue ≥ 3 mm es positivo a TB La sensibilidad y especificidad reportada para esta prueba es de entre 86-96% y 70-85%, respectivamente.
» Prueba cervical comparada
La PT comparada permite diferenciar potenciales reacciones cruzadas con otras micobacterias que contienen proteínas análogas a M. bovis. Para ello, se inocula en el tercio medio del cuello 0,1 mL de PPD bovina y a unos 12-15 cm de distancia 0,1 mL de PPD aviar. Para diferenciarlas visualmente, el PPD aviar tiene un colorante rojo agregado a su formulación. A las 72 hs se vuelve a cuantificar el tamaño de ambos pliegues.
Si el tamaño de reacción es mayor a PPD bovina (≥ 4 mm) que al PPD aviar el animal es positivo a TB mientras que si la diferencia es menor (≤ 2 mm) a la reacción de PPD aviar, se considera negativo a TB. Un valor intermedio será sospechoso. La sensibilidad y especificidad reportada es de entre 72-78% y 96-98%, respectivamente.
Otras pruebas diagnósticas
Diversas pruebas diagnósticas han sido investigadas con el objeto de mejorar el diagnóstico de TB bovina.
Algunos ejemplos de pruebas sanguíneas desarrolladas son: El test de gama interferón, que se basa en la cuantificación de este mediador químico liberado por células sensibilizadas a M. bovis, luego de ser expuestas antígenos específicos. Esta prueba tiene, en su esencia, un paralelismo con la PT.
La implementación del test de gama interferón, requiere de una logística especial de transporte y conservación de la muestra de sangre hasta su procesamiento en laboratorio.
Por otro lado, la prueba de enzimoinmunoanálisis (ELISA) evalúa la inmunidad humoral (anticuerpos) siendo entonces, complementaria a las anteriormente mencionadas.
El ELISA tiene ventajas operativas que facilitan su implementación y aunque tiene reportada una baja sensibilidad, en algunos países se la emplea para detectar potenciales animales anérgicos a la PT.
Toda prueba diagnóstica que contribuya a identificar bovinos con TB será de gran ayuda para los programas de control y erradicación. Para ello, las pruebas deben ser validadas en condiciones de campo para establecer su eficacia y precisión para clasificar a los animales.
Conclusión
Los esfuerzos para detectar la TB bovina comenzaron desde hace más de 100 años, promovidas por veterinarios innovadores y con investigaciones de avanzada. Sus trabajos sobre la PT fueron tan revolucionarios que, hasta la actualidad y con escasas modificaciones, no se ha logrado remplazar su eficacia y practicidad por nuevos desarrollos tecnológicos.
En Argentina, y para el año 2019, el 62% de las unidades productivas bovinas obligadas al saneamiento (tambos y cabañas) estaban declaradas oficialmente libres de TB. Por otro lado, y durante ese año, el 10% de unidades productivas de bovinos enviaron a faena animales con lesiones compatibles con TB.
Estos datos son preocupantes y sugieren que la TB bovina continúa siendo un problema importante en la ganadería.
Al mismo tiempo, se destaca que ambas tuberculinas (PPD bovina y PPD aviar) son producidas en Argentina bajo normas estándares internacionales y su potencia biológica y otros factores intrínsecos, son exhaustivamente controlados.
En este contexto, es probable que la PT continúe siendo por muchos años más, el eje central para la detección de TB en el ganado bovino.
Figura N° 1. Esquema representativo de los estados de la tuberculosis bovina. En los estados iniciales y finales, el bovino infectado puede no presentar reactividad a la prueba de la tuberculina.
Los esfuerzos para detectar la TB bovina comenzaron desde hace más de 100 años, promovidas por veterinarios innovadores y con investigaciones de avanzada. Sus trabajos sobre la PT fueron tan revolucionarios que, hasta la actualidad y con escasas modificaciones, no se ha logrado remplazar su eficacia y practicidad por nuevos desarrollos tecnológicos.
En Argentina, y para el año 2019, el 62% de las unidades productivas bovinas obligadas al saneamiento (tambos y cabañas) estaban declaradas oficialmente libres de TB. Por otro lado, y durante ese año, el 10% de unidades productivas de bovinos enviaron a faena animales con lesiones compatibles con TB.
Estos datos son preocupantes y sugieren que la TB bovina continúa siendo un problema importante en la ganadería.
Al mismo tiempo, se destaca que ambas tuberculinas (PPD bovina y PPD aviar) son producidas en Argentina bajo normas estándares internacionales y su potencia biológica y otros factores intrínsecos, son exhaustivamente controlados.
En este contexto, es probable que la PT continúe siendo por muchos años más, el eje central para la detección de TB en el ganado bovino.

MV Carlos Garro
Médico veterinario de la Universidad Nacional de Río Cuarto, Córdoba.
Master Scientiae en Sanidad Animal de la Universidad Nacional de Mar del Plata. Investigador del grupo de Epidemiología y Medicina Preventiva del Instituto de Patobiología Veterinaria. Centro de Investigaciones en Ciencias Veterinarias y Agronómicas. INTA Castelar.
Miembro de la Comisión Científica de Micobacterias de la Asociación Argentina de Veterinarios de Laboratorios de Diagnóstico.




